В прошлой статье, посвященной новинкам рынка фармацевтического сырья, мы рассказывали об ингредиентах и целых решениях преимущественно для производства твердых лекарственных форм. На этот раз сосредоточимся на жидких лекарственных препаратах.
Перечень основных требований, предъявляемых к стерильным жидким лекарственным формам, определяется типом препарата и специфическими нормами, приведенными в монографиях.
Но существуют универсальные параметры:
- Стерильность и апирогенность
- Полное либо практически полное отсутствие невидимых глазу частиц (в соответствии с требованиями EP, USP, JP, ДФУ)
- Отсутствие границы раздела фаз для эмульсий, агрегатов частиц – для водных дисперсий
- В случае, если препарат представляет собой суспензию, после встряхивания он должен быть полностью гомогенным для обеспечения экстракции и введения пациенту корректной дозы АФИ
Звучит просто, коротко и ясно, но согласно статистике FDA по отзывам партий стерильных препаратов за 2008–2012 годы, самые распространенные отклонения – отсутствие надлежащих доказательств стерильности (22% случаев), наличие видимых частиц (22%) и совокупность факторов в виде несоответствия pH, окраски, несоблюдения температурных режимов и т.д. (47%).
Дальнейшие расследования этих случаев выделили несколько основных причин таких инцидентов:
- Компромиссы в качестве сырья (как АФИ, так и наполнителей)
- Нестабильность рецептуры
- Отклонения процесса на стадии фильтрования
- Дефекты технологической линии (трубопроводов, реакторов) либо
- Нарушение герметичности упаковки готового ЛС.
В этой статье мы не будем углубляться в нюансы технологии, а остановимся на наиболее распространенных замечаниях – стерильности и наличии включений. Как качество сырья влияет на данные показатели для конечного продукта.
Апирогенность
Фармакопея определяет стерильность как полное отсутствие жизнеспособных микроорганизмов, которое обеспечивается технологическим процессом. При этом для инфузионных растворов важна не только стерильность, но и апирогенность – отсутствие в препарате продуктов жизнедеятельности и частей микроорганизмов. Подтвердить соответствие можно при помощи так называемого ЛАЛ-теста (в этом случае речь идет о бактериальных эндотоксинах) либо теста на животных (результат будет учитывать в том числе содержание пирогенов неэндоксической природы).
Откуда берутся эндотоксины?
Представим такую ситуацию: в процессе производства мы получили некий раствор, в который попала грамотрицательная бактерия. После стерилизации бактерия потеряла жизнеспособность, но в растворе остались липополисахариды – части внешней мембраны, один из самых сильных природных стимуляторов иммунного ответа. Именно эти вещества могут стать причиной септического шока.
Выделяют три основных источника эндоксинов: сырье, производственное оборудование и упаковка (например, крышки виал и флаконы).
Как избавиться от эндотоксинов?
Липополисахариды устойчивы к паровой стерилизации, разрушить их может только сухой жар, но такой температурный режим недопустим для препарата. Невыгодна и фильтрация: подобные частицы удерживаются фильтрами с размером ячейки 0,025 мкм, что в разы удорожает технологический процесс.
Деконтаминация оборудования может проводиться при промывке линий 0,1М раствором гидроксида натрия или другими растворами, можно провести обработку упаковочных материалов. Но в случае с сырьем, фильтрами, полимерной упаковкой самый надежный способ – обращать внимание на материалы с сертификатами от производителя, подтверждающими отсутствие эндоксинов. То есть вывод один – проще не допустить появления, чем избавиться: качественное сырье для производства стерильных лекарственных форм должно сопровождаться пакетом документации, содержащей параметр «Эндоксины».
Частицы
Все частицы, выявляемые в препаратах, разделяют на три основных группы:
| Определение | Термин USP | Пример | Степень риска для пациента и/либо соответствия GMP |
| Состоят полностью из компонентов лекарственного средства | Inherent | Агломераты | Низкая Материал охарактеризован должным образом |
| Фрагменты объектов –частей производственного процесса | Intrinsic | Частицы нержавеющей стали, ржавчины, полимеров (уплотнители, упаковочные и смазочные материалы) | Средняя Присутствие материала приемлемо в случае соответствия критериям приемлемости и тестовым процедура |
| Частицы, не имеющие отношения к производственному процессу | Extrinsic | Пыль, волосы, кожа, насекомые, волокна нерегламентированной длины | Высокая Попадание частиц полностью предотвратимо и неприемлемо. Необходимо тщательное расследование причин появления. Продукт подлежит утилизации. |
Как подобрать сырье?
Для обеспечения вышеперечисленных характеристик наполнители, которые используются при производстве. должны быть биологически совместимыми, предназначенными для конкретной задачи и присутствовать в минимальной эффективной концентрации.
Функции таких наполнителей в лекарственной форме следующие:
- Сделать препарат изотоническим по сравнению с кровью (например, глюкоза/декстроза, маннитол, хлорид натрия)
- Приблизить pH к физиологическому (минеральные либо органические соли и кислоты)
- Предотвратить деградацию лекарственного средства (стабилизаторы)
- Гарантировать либо улучшать растворимость субстанции
- Для ЛС в упаковках с несколькими дозами (например, капли) – обеспечивать антимикробные и консервирующие свойства на надлежащем уровне
Компаниям Merck занимается не только производством, но и разработкой сырья для фармацевтических производств, уделяя внимание как качеству каждого продукта, так и удобству упаковки.
Сырье для стерильных лекарственных форм производится в условиях, соответствующих требованиям GMP, ведется контроль изменений и проверка качества каждой выпущенной партии. Особое внимание уделяется контролю микробиологических показателей и содержания эндотоксинов. Значения этих параметров приведены в сертификате анализа.
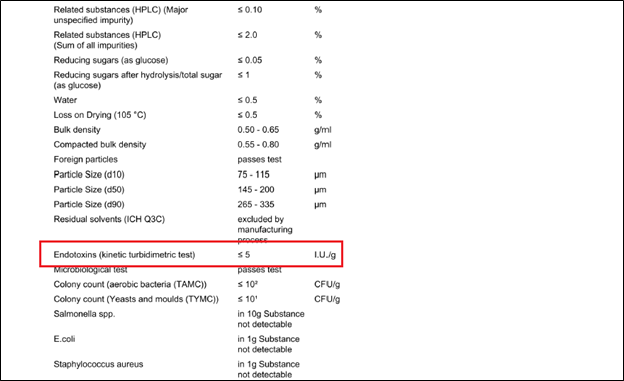
Рис. 1. Пример сертификата анализа с приведенным значением параметра «Эндотоксины»
Для снижения рисков внесения микробиологического загрязнения продукции в производстве используются исключительно очищенная вода и воздух. Сушка конечного продукта проводится осаждением либо распылением.
Для контроля содержания частиц, которые могут вноситься в продукт с сырьем, компания Merck применяет риск-ориентированный подход, генерируя в случае необходимости дополнительные отчеты о частицах, присутствие которых обусловлено спецификой производственного процесса (группа 2 из таблицы, приведенной выше).
 Структура этого отчета предполагает наличие таких разделов:
Структура этого отчета предполагает наличие таких разделов:
- Схема производственного процесса
- Информация о частицах:
- Изображение, сведения о составе
- Происхождение
- Баланс масс
- Причина появления
- Заключение о дополнительных микробиологических и BSE-рисках
- Программа по устранению
Такой отчет обязательно включается в досье (Operational Excellence Dossier), что дает возможность пользователю оперативно принимать решения о корректировках производственного процесса и оценивать риски.
Для удобства работы и минимизации количества испускаемых частиц сырье Merck поставляется в упаковке, не содержащей бумагу, с проверенной стабильностью при хранении.
Что в ассортименте?
В портфеле компании Merck есть все необходимое для разработки и производства стерильных лекарственных форм:
- Регуляторы pH и буферы
- Консерванты и антиоксиданты
- Растворители, загустители и стабилизаторы
- Поверхностно-активные вещества
- Регуляторы тоничности
- Системы доставки фармацевтических субстанций
Компания «ХИМЛАБОРРЕАКТИВ» как официальный дистрибьютор продукции Merck на территории Украины готова оказать методическую поддержку, предоставить тестовые образцы и провести презентацию для Вашей лаборатории.